近日,微生物技术国家重点实验室刘双江教授团队与合作单位团队在nature microbiology上发表了题为“gut commensal christensenella minutamodulates host metabolism via acylated secondary bile acids”的研究论文,揭示小克里斯滕森氏菌等肠道共生菌通过产生新型次级胆汁酸——酰基胆酸,靶向肠肝信号轴调控宿主糖脂代谢的新机制;并证明小克里斯滕森氏菌及酰基胆酸具有治疗ii型糖尿病等慢性代谢类疾病的应用潜力。
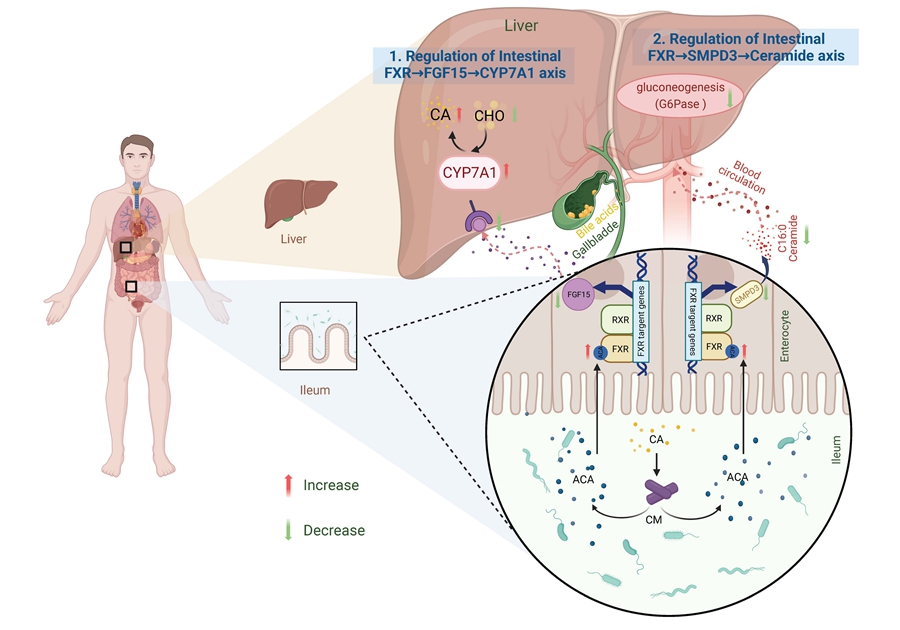
图1.小克里斯滕森氏菌缓解糖脂代谢异常机制示意图
随着现代生活方式和高脂高糖饮食的普及,肥胖、脂肪肝、ii型糖尿病等代谢性疾病的流行程度越来越高,其发病率逐年上升,并表现出年轻化的趋势,已成为全球范围内的健康威胁,寻找新的治疗方法和防治策略尤为重要。
研究团队首先通过对多个代谢类疾病人群队列的肠道宏基因组数据进行整合分析,鉴定到150余个肠道菌种在代谢类疾病人群中丰度显著下降,随后对其中的88个可培养的菌种进行胆酸转化谱表征,发现以小克里斯滕森氏菌(christensenella minuta)为代表的8个菌种可以对胆酸进行3-o-酰基化修饰,产生一类全新的次级胆汁酸,这是迄今发现的第六种微生物介导的胆汁酸修饰新模式。动物实验证明,给药c. minuta可以显著改善模型小鼠的糖脂代谢异常,同时伴随着回肠酰基胆酸的显著增加。体外实验随后证明酰基胆酸为一类全新的肠道特异性法尼醇x核受体(fxr)天然拮抗剂;在机制上,c. minuta通过产酰基胆酸靶向抑制肠fxr,调控肠肝信号轴发挥缓解糖脂代谢异常的功能表型,且这种益生效果在肠上皮fxr特异性敲除小鼠中完全消失。最后,通过人群队列实验证明,3-o-酰基胆酸在健康人粪便中广泛存在,在ii型糖尿病患者中明显降低,暗示了在动物实验中看到的功能与机制可能在真实世界中也同样存在。这一工作证明了小克里斯滕森氏菌和酰基胆酸在ii型糖尿病等代谢性疾病的治疗与预防中具有应用前景。这项研究强调了肠道共生菌及其功能代谢产物在宿主代谢稳态中的重要作用,为代谢性疾病的治疗和预防提供了全新的思路。
山东大学研究员刘畅、博士研究生杜梦璇和河北大学硕士研究生谢莉生为本文的共同第一作者,山东大学/中国科学院微生物研究所特聘教授刘双江、中国科学院研究员刘宏伟和北京大学教授姜长涛为本文共同通讯作者。山东大学为第一完成单位和通讯作者单位。本研究得到了国家重点研发计划、国家杰出青年科学基金和微生物技术国家重点实验室创新研究群体等项目的支持。
文章链接:


