转分化是实现细胞命运重编程的方式之一。转分化无需经过多潜能细胞状态,便能直接地产生新的细胞类型。基于此特点,在组织损伤修复或再生过程中,将损伤部位存留的其它正常细胞原位转分化为受损细胞,是目前研究热点之一。因此,该过程的转化过渡态和驱动机制急需深入表征和解析,以期实现转分化的转化应用价值。
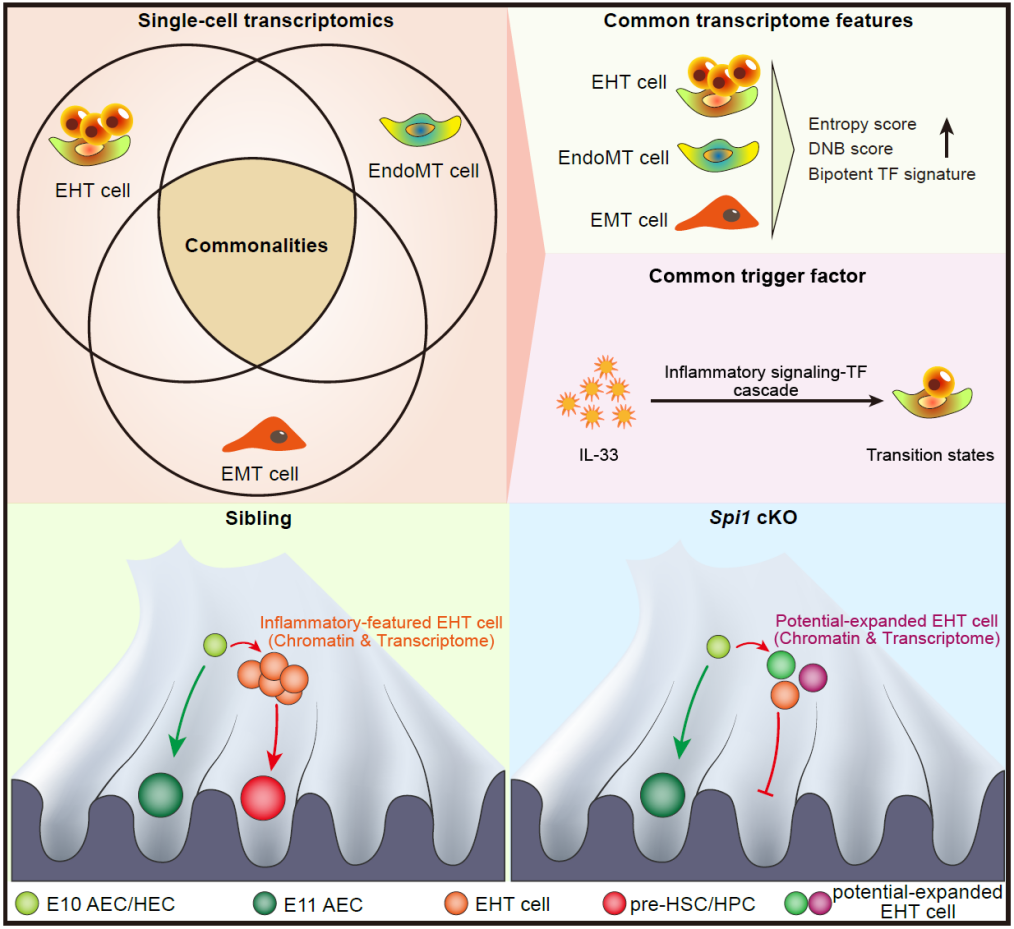
刘峰团队以斑马鱼和小鼠为模式生物,长期致力于研究造血干细胞发育与再生的调控机制。脊椎动物造血干细胞通过“内皮–造血转化(endothelial-to-hematopoietic transition,eht)”的转分化过程产生,该过程主要发生于胚胎主动脉腹侧壁。近年来,该团队围绕eht取得了一系列研究进展,包括鉴定了转化过渡态异质性及异质性亚群标记分子spi2等。为了进一步探索转分化的普适性原理,该团队以小鼠胚胎为模型,对eht、“内皮–间质转化(endothelial-to-mesenchymal transition,endomt)”和“上皮–间质转化(epithelial-to-mesenchymal transition,emt)”三个过程进行了联合分析。2024年3月19日,刘峰团队在知名期刊developmental cell发表了题为“single-cell omics identifies inflammatory signaling as a trans-differentiation trigger in mouse embryos”的研究论文。该工作利用单细胞联合组学和功能分析,发现炎性信号可以作为转分化过程中一种共性驱动力。

研究人员首先对主动脉区cd31 细胞(包括内皮细胞、过渡态细胞和造血干/祖细胞前体细胞)进行了单细胞转录组测序,同时也收集了已发表的骨髓endomt和小肠emt单细胞转录组数据。通过对这些数据进行定量得分分析和联合对比分析,研究人员发现,三种转分化过渡态均具有:(1)增强的命运可塑性(转录组熵值);(2)起始/终末态双潜能特征(转录因子表达得分);(3)临界转变状态特征(动态网络生物标记得分)以及(4)富集的炎性基因表达特征。鉴于促炎因子白介素33(interleukin-33,il-33)可以驱动endomt和emt,研究人员通过功能实验发现外源添加il-33也能够驱动主动脉区eht,这说明il-33可以作为这三种转分化过程中的一个共性驱动因子。为了动态模拟转分化过程并鉴定关键驱动信号,研究人员以eht为例重构了转录组向量场(一种基于细胞转录状态预测细胞命运的算法),结果发现过渡态命运转化关键节点存在明显的炎性基因转录特征。值得注意的是,该团队既往一项研究发现tlr4–myd88–nf-κb炎性信号通路能调控造血干/祖细胞产生,这些发现说明炎性信号是eht的关键驱动信号;研究人员同时也对eht进行了单细胞染色质开放性分析,结果发现炎性基因调控元件的染色质在过渡态中呈现开放状态。为了进一步解析炎性信号调控机制,研究人员筛选得到了一个炎性信号效应转录因子spi1,通过构建内皮细胞基因敲除小鼠品系,发现eht和造血干/祖细胞产生受损。对该突变体进行单细胞转录组/染色质开放性联合分析,研究人员发现过渡态中造血分子程序未正常启动,而内皮分子程序和endomt/间质细胞分子程序呈现过度或异常激活状态,这说明spi1对于维持eht分子程序有序动态变化至关重要。最后,研究人员通过外源添加白介素和过表达spi1可以诱导小鼠胎肝/骨髓内皮细胞(生理情况下无eht能力)发生eht并产生血细胞,这说明操纵炎性因子及其效应因子组成的信号轴可以驱动转分化的发生。
刘峰教授为本文的通讯作者。山东大学生命科学学院博士后张一帆和中国科学院动物研究所博士研究生康志鑫为该论文的共同第一作者。该研究得到了国家自然科学基金和国家重点研发计划的资助。
原文链接:


