近日,微生物技术国家重点实验室(微生物技术研究院)李盛英教授团队和张友明教授团队联合攻关,在我国科学家发现的第一个具有全新骨架抗生素——创新霉素的生物合成中,发现了一种全新的硫原子引入机制,相关研究结果以“biosynthesis of chuangxinmycin featuring a deubiquitinase-like sulfurtransferase”为题,发表在化学领域权威期刊《德国应用化学》(angewandte chemie international edition, if: 15.336),被编辑部遴选为very important paper(vip),并受邀创作封面图片展示研究成果。张伟教授为论文主通讯作者,李盛英教授和卞小莹教授为共同通讯作者;张兴旺助理研究员为论文第一作者。山东大学微生物技术国家重点实验室为第一作者和通讯作者单位。
“硫”是维持生命的必需元素之一,含硫有机小分子天然产物是一类重要的活性功能化合物,而硫原子往往是其发挥生物学功能的关键。硫原子的引入过程涉及到复杂的微生物初级代谢机制和次级代谢机制的密切沟通,伴随着新颖的生化反应和酶学机理,一直受到生物学家和化学家的广泛和持续关注。
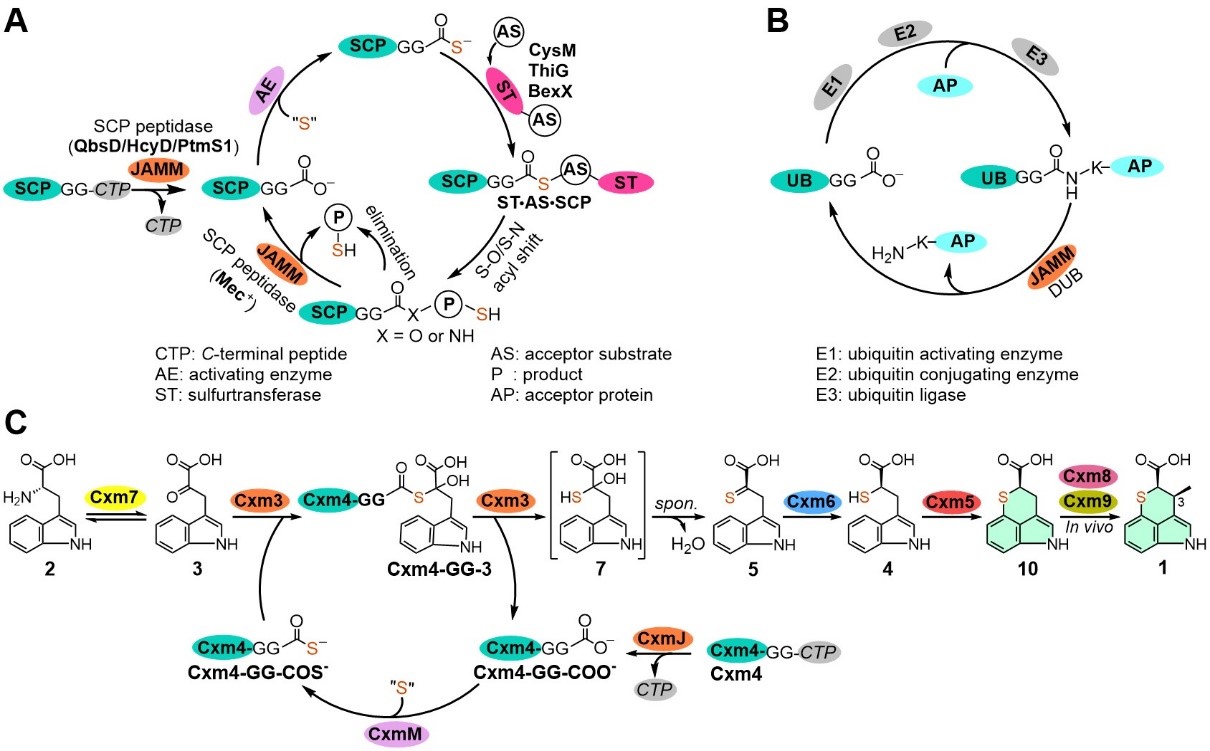
创新霉素是由我国科学家于二十世纪六十年代中期,从济南游动放线菌中首次发现的含硫抗生素,具有新颖的吲哚骈二氢噻喃环(tpi)骨架结构,被认为是中国第一个发现的全新结构抗生素。创新霉素能够特异性靶向抑制细菌色氨酰trna合成酶(trprs)活性,是重要的新型抗生素候选分子。
本研究中,作者发现jamm家族金属蛋白酶cxm3能够在zn2 的介导下,将硫载体蛋白(cxm4gg-cos-)中的硫原子转移到底物小分子,实现创新霉素结构中硫原子的引入。人工智能(ai)蛋白结构预测分析发现,cxm3与真核生物和古菌中的jamm家族去泛素化酶(deubiquitinase)具有相似的三维结构,并能与硫载体蛋白cxm4gg(类泛素蛋白)形成复合物;氨基酸残基突变实验证实,cxm3蛋白催化中心的锌离子介导全新硫转移反应。重要的是,cxm3与cxm4gg之间的蛋白-蛋白互作机制与真核生物和古菌中的去泛素化方式极为类似。在此基础上进一步通过“一锅反应法”反应,在体外高效地重构了去甲基创新霉素的生物全合成。
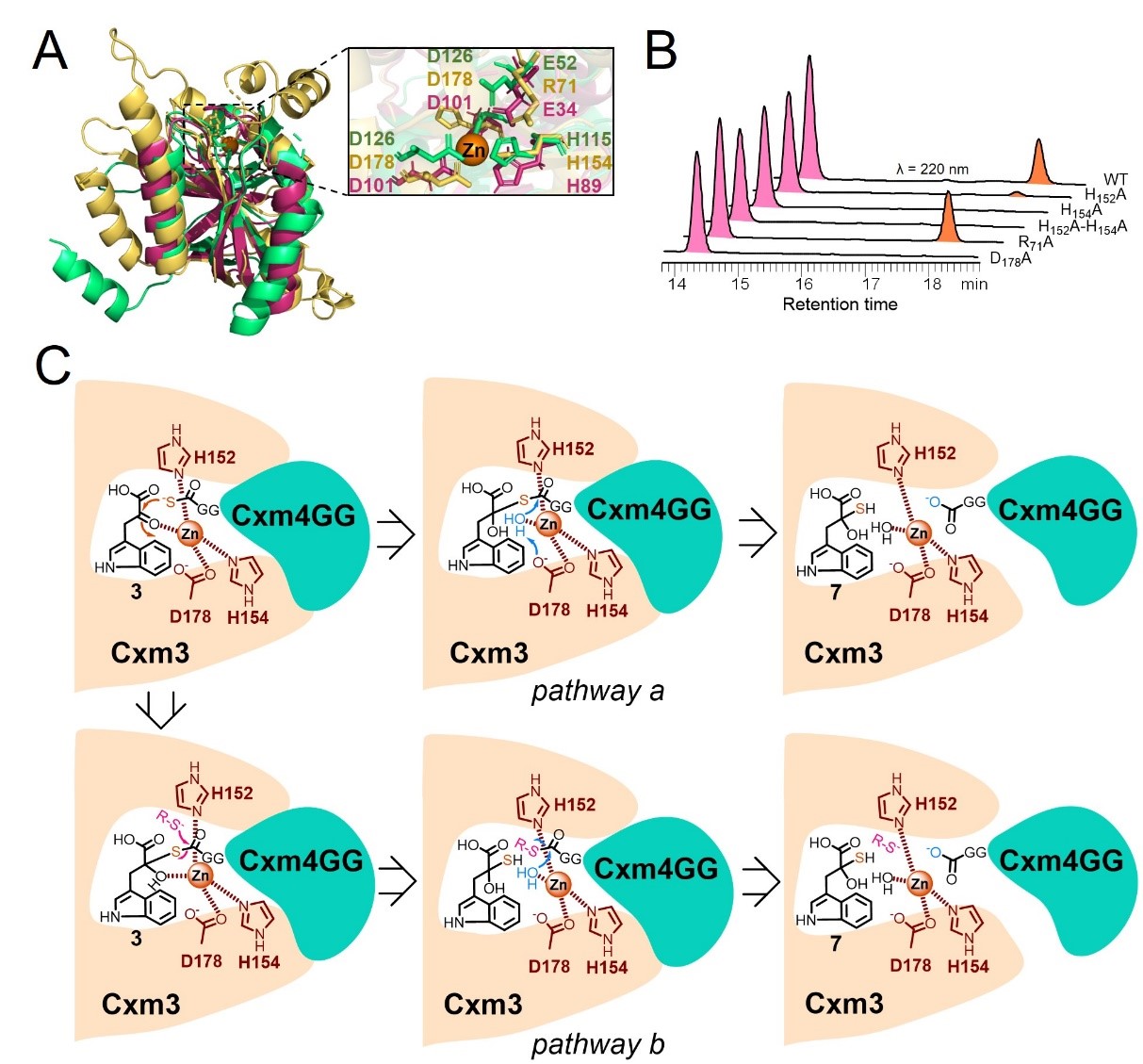
本研究中jamm家族新成员,即新颖硫转移酶cxm3的发现,揭晓了这一历时50余年的硫引入途径的生物合成谜底,更进一步丰富和拓展了jamm家族蛋白催化反应的化学和功能多样性。类去泛素化过程的硫原子引入机制的发现,不仅拓宽了对天然产物结构中硫原子引入策略的认识,而且为从基因大数据中挖掘发现更多类去泛素化酶类型的硫转移蛋白及其参与合成的含硫天然产物奠定了重要的酶学基础。
本研究得到了国家重点研发计划、国家优秀青年科学基金、国家杰出青年科学基金和山东省杰出青年基金等科研项目的支持。
论文链接:


