近日,微生物技术国家重点实验室李盛英教授团队和厦门大学王斌举教授团队合作,以α,β-不饱和脂肪酸为底物探针,对三个cyp152家族的代表性p450过加氧酶oletje、p450spα和p450bsβ进行催化反应分析,首次揭示了一种由p450过加氧酶活化过氧化氢产生临近水分子介导的碳-碳键断裂新机制,相关研究结果以“unexpected reactions of α,β-unsaturated fatty acids provide insight into the mechanisms of cyp152 peroxygenases”为题,发表在化学领域权威期刊《德国应用化学》(angewandte chemie international edition,if: 15.336)。山东大学微生物技术国家重点实验室为第一单位,李盛英教授和王斌举教授为共同通讯作者,博士后蒋媛媛、李众以及厦门大学博士研究生彭炜为论文共同第一作者。
细胞色素p450酶具有极为丰富的底物结构和催化反应多样性,可在温和条件下催化惰性碳氢键的选择性氧化,因而具备化学催化剂难以比拟的优势,被誉为自然界的“万能催化剂”。绝大多数p450酶具有共同的单氧合机制,以o2、nad(p)h和氧化还原伴侣蛋白分别作为氧供体、电子源和电子穿梭体。少数p450酶如cyp152过加氧酶则可直接利用h2o2作为唯一的氧和电子供体,通过过氧化氢分支途径驱动p450酶的催化反应循环。
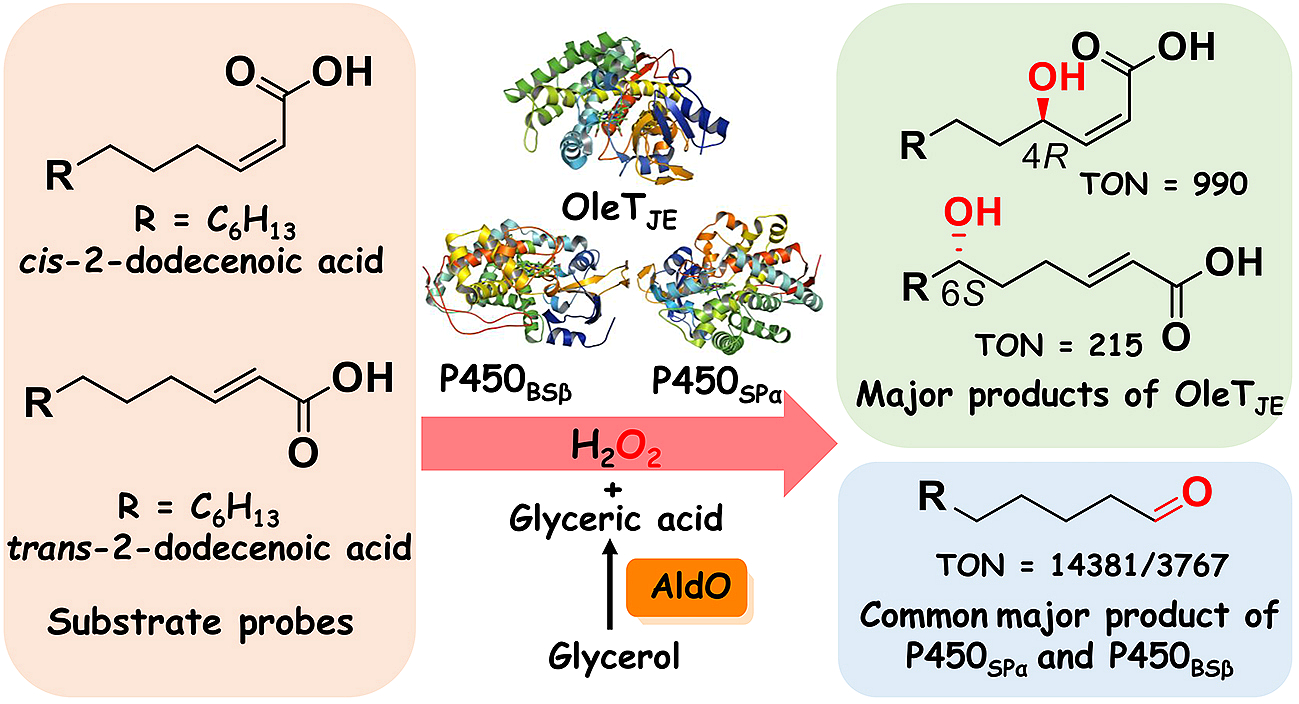
来自咸海鲜球菌(jeotgalicoccus sp. atcc 8456)的cyp152家族成员oletje能以h2o2为辅因子,直接催化脂肪酸一步氧化脱羧得到高附加值产物α-烯烃,在过去十年中引起了生物燃料和生物材料领域的极大关注。与之不同的是,同家族的脂肪酸羟化酶p450spα和p450bsβ主要催化脂肪酸羟基化反应,分别生成α-和β-羟基脂肪酸。cyp152家族p450过加氧酶独特的化学选择性和区域选择性的分子基础,尤其是底物构象和电子性质如何影响该类酶的催化模式一直是近期国际酶学研究的前沿热点领域。
本研究中,以顺/反-2-十二碳烯酸作为底物探针,作者对三个cyp152家族的代表性成员(oletje、p450spα和p450bsβ)进行了细致的反应分析。底物探针的引入,使p450脂肪酸脱羧酶oletje仅表现出羟基化反应活性;oletje对反-2-十二碳烯酸的6s-羟基化和顺-2-十二碳烯酸的4r-羟基化揭示了其对不同构型底物的区域选择性差异。分子对接分析表明该选择性差异是由于oletje偏好c2-c3的顺式构型所引发。
令人意外的是,除了顺/反-2-十二碳烯酸的双键环氧化产物,p450spα和p450bsβ主要产生碳-碳键断裂产物十一醛。作者结合同位素标记的h218o2示踪实验、md模拟和qm/mm计算,阐明了由高反应活性中间体compound i介导的成醛反应新机制。该反应是一种“非常规”p450反应,由h2o2活化产生的临近水分子的氢原子夺取所引发。该机制与oletje催化饱和脂肪酸的碳-碳键断裂脱羧反应完全不同,因为oletje催化的碳-碳键断裂反应由典型的底物cβ-h攫氢所引发。值得一提的是,p450spα和p450bsβ也可催化其它不同链长的α,β-不饱和脂肪酸碳-碳键断裂合成相应的脂肪醛产物。
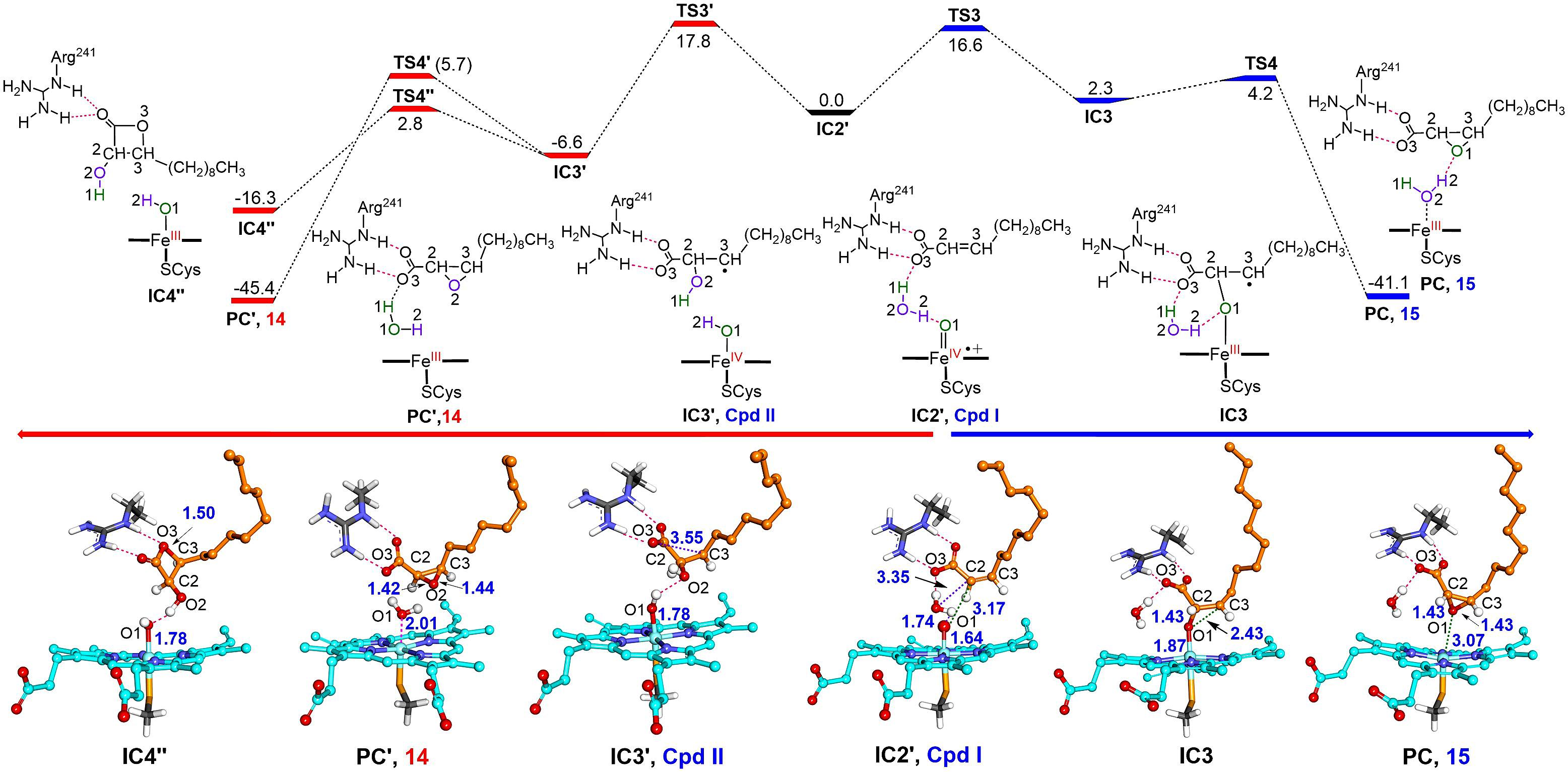
本研究首次解析了h2o2活化产生的临近水分子在cyp152过加氧酶催化中的关键作用,深化了学术界对细胞色素p450酶催化碳-碳键断裂机制的理解。 p450spα催化顺-2-十二碳烯酸体系高达14381的总转化数为脂肪醛的生物合成提供了一条全新、简单且高效的酶催化方案。由于脂肪醛是重要的化学中间体,广泛用于香料和调味剂的生产,因此该工作具有广阔的实际应用前景。
本研究得到了国家杰出青年科学基金、国家重点研发计划和山东省自然科学基金等科研项目的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202111163


