近日,前沿交叉科学青岛研究院李春霞教授团队在上转换纳米粒子用于癌症免疫治疗研究方面取得新进展,相关研究成果以“tumor microenvironment-activated reactive oxygen species amplifier for enzymatic cascade cancer starvation/chemodynamic /immunotherapy”为题发表在著名国际学术期刊advanced materials(化学一区,if:30.849)。山东大学为该论文的第一完成单位。
近年来,免疫治疗在对抗癌症转移和复发方面取得了重大的突破。特别是一些免疫治疗方法,如免疫检查点阻断(icb)策略、过继性t细胞治疗(act)和癌症疫苗等已经取得了显着的临床成果。遗憾的是,由于肿瘤微环境(tme) 固有的免疫抑制作用,只有一小部分患者可以对免疫治疗产生反应。因此,逆转免疫抑制性 tme 对于提高实体瘤对免疫治疗的敏感性至关重要。研究表明,具有活性氧(ros)生成能力的纳米材料已表现出显着的肿瘤相关巨噬细胞(tam) 调节功能,可将促肿瘤m2表型tam重新极化为抗肿瘤m1表型tam。
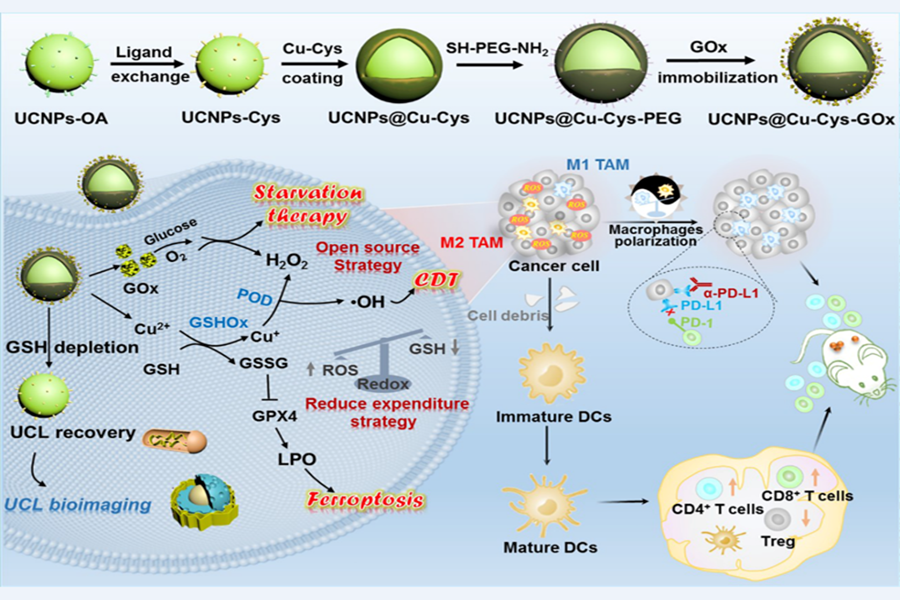
为此,李春霞教授团队与中科院长春应化所林君研究员、广州医科大学侯智尧教授合作,设计了一种基于上转换纳米粒子(ucnps)、肿瘤微环境激活的酶级联纳米催化剂(ucnps@cu-cys-gox),它可以通过开源节流的方式促进ros的产生。该复合材料的最大特点是在正常组织中保持惰性(off),只有在肿瘤微环境中才会被特异性激活(on),从而发生一系列酶级联反应:cu-cy与gsh反应生成cu 和gssg,gsh的消耗减少了对ros的清除;同时,生成的芬顿试剂cu 与过表达的h2o2发生反应产生细胞毒性的•oh(cdt);cu-cy 的降解导致ucnps的上转换荧光恢复,可用于体内的活体成像。研究发现ros的产生可以诱导巨噬细胞的极化,促使巨噬细胞从免疫抑制的m2表型重新编码为促炎、抗肿瘤的m1表型,从而有效逆转肿瘤免疫抑制微环境。进一步与免疫检查点阻断剂anti-pd-l1结合,发现材料对远端肿瘤也有更好的抑制作用。
总之,本研究提出了一种肿瘤微环境特异性激活纳米材料的新思路,实现了肿瘤饥饿/cdt/免疫协同治疗。文章第一作者是前沿交叉科学青岛研究院博士生王曼和中科院长春应化所博士生常梦宇。上述工作得到了国家自然科学基金原创探索等项目的支持。
原文链接:


