近日,微生物技术国家重点实验室武大雷团队与中科院上海药物所罗成团队及牛津大学fraydoon rastinejad团队合作,在nature communications上在线发表了题为identification of oleoylethanolamide as an endogenous ligand for hif-3α的论文。微生物技术国家重点实验室博士研究生刁晓彤和浙江理工大学叶飞教授为该文章共同第一作者,武大雷教授、罗成研究员和fraydoon rastinejad教授为论文共同通讯作者,山东大学为第一及通讯作者单位。
缺氧诱导因子(hypoxia-inducible factors, hifs)是细胞适应氧气浓度变化并调控生理功能的一类重要转录因子,kaelin、ratcliffe和semenza三位科学家因发现hif及其作用机制于2019年获得诺贝尔生理与医学奖。在常氧条件下,脯氨酸羟化酶以氧气为底物,将hif-α特定位点的脯氨酸羟基化,使其通过泛素途径降解;而缺氧条件下,hif-α因羟基化受阻而维持稳定,从而激活hif通路。除了依赖氧气的蛋白稳定性调控,hif-α还可以被人工合成的小分子配体直接结合并调节其转录活性,例如2021年上市的肾透明细胞癌药物belzutifan,就是hif-2α的变构抑制剂。然而直接靶向hif-α蛋白并调控其活性的内源小分子此前尚未发现,探寻内源性配体一直是hif研究领域的热点问题之一。
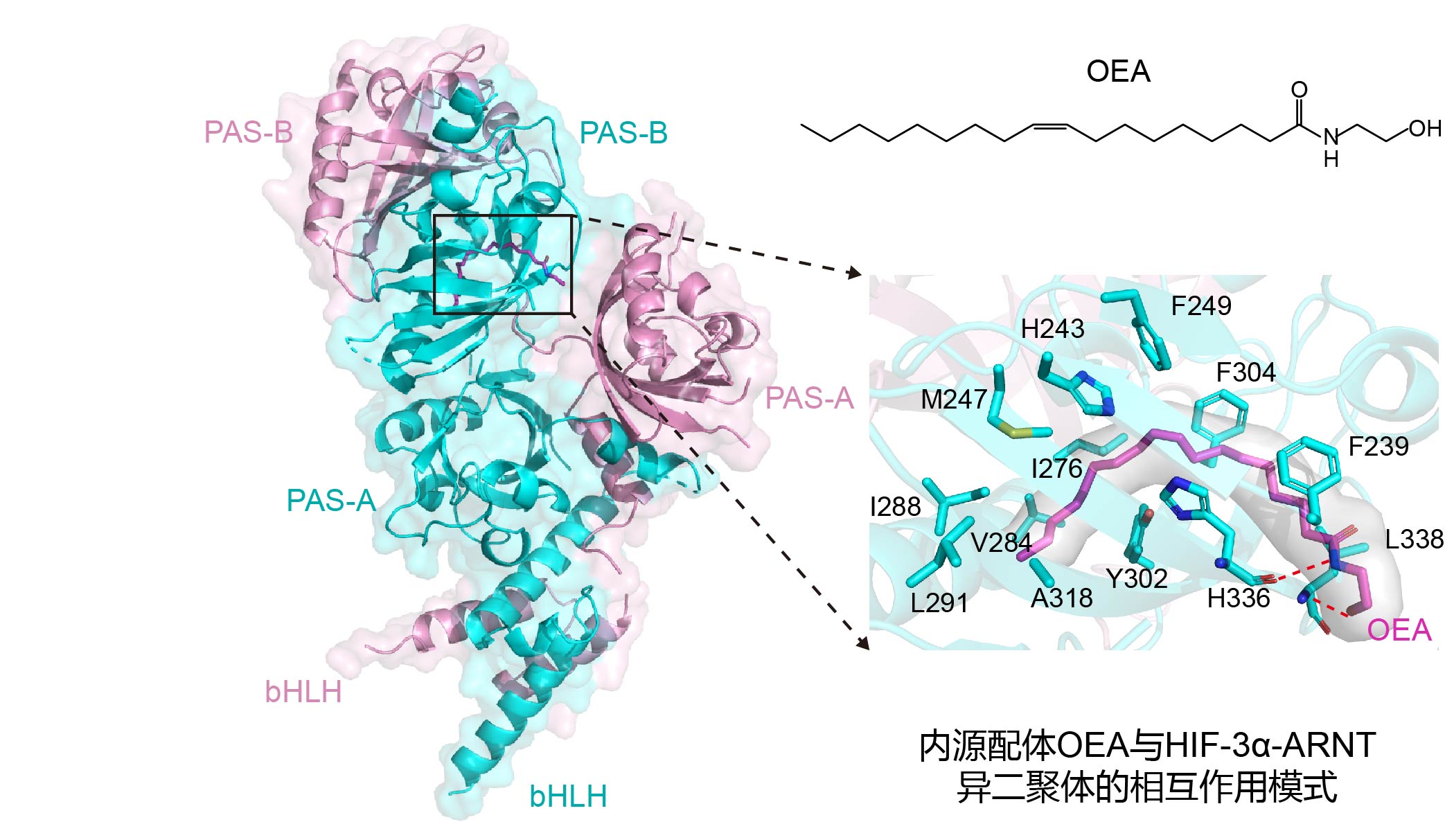
该研究首次发现了直接结合hif-3α蛋白的脂类内源性配体油酰乙醇胺(oleoylethanolamide,oea)。通过解析hif-3α-arnt-oea复合物晶体结构,结合分子动力学模拟、氢氘交换质谱分析和细胞水平功能实验等,揭示了oea如何进入hif-3α、促进hif-3α-arnt异二聚体稳定性、增强hif-3α对下游基因转录活性的具体分子机理。证明在依赖氧气的蛋白翻译后修饰机制之外,存在内源性配体(特别是代谢产物)参与调控hif通路活性。天然或内源性配体的存在,不仅丰富了hif-α的生理功能和活性调控方式,还可以增大hif-α靶向药物研发的成功几率,正如很多核受体靶向药物由其内源性配体发展而来。值得一提的是,hif-3α可结合微生物来源的小分子,该研究暗示hif-3α有望作为肠道菌群通过代谢产物调控宿主转录因子信号通路的关键受体之一。
武大雷教授团队主要针对转录因子相关的靶标蛋白,从事结构与分子药理学研究和靶向分子发现,此外也开展生物合成相关酶的结构解析和催化机理研究,相关研究成果先后发表在nature chemical biology(2019)、nature communications(2021, 2022)等期刊。此项研究工作得到了国家自然科学基金、山东省杰出青年基金、青年泰山学者和山东大学青年交叉科学创新群体等项目的资助。山东大学生命环境研究公共技术平台、国家蛋白质科学研究(上海)设施和上海同步辐射光源为本工作提供了重要支持。


