近日,微生物技术国家重点实验室环境微生物与合成生物学团队在氧化还原生物学领域权威期刊redox biology杂志(中科院一区top,if=11.779)上在线发表题为“rhodaneses minimize the accumulation of cellular sulfane sulfur to avoid disulfide stress during sulfide oxidation in bacteria”的研究论文。博士后冉明雪为论文第一作者,荀鲁盈教授和夏永振教授为文章通讯作者,山东大学微生物技术国家重点实验室为第一完成单位。
硫化氢(h2s)作为一种新型的气体信号分子,对细胞的生理活动起到非常重要的调控作用,但在高浓度下会对机体产生毒性。异养细菌中一条主要的h2s氧化途径由硫醌氧化还原酶(sqr)、过硫化物双加氧酶(pdo)组成,其中sqr氧化h2s为零价硫烷硫(s0)并传递给谷胱甘肽,产生谷胱甘肽过硫化物(gssh),pdo氧化gssh生成亚硫酸盐,亚硫酸盐与s0自发产生硫代硫酸盐。课题组前期已从生化、结构、调控、分布和生理生态作用等多个角度对这条途径进行了解析。
在解析已知的sqr-pdo途径组成的操纵子结构时,经常会发现有一类硫氰酸酶(rhodanese, rhod)结构域伴随其中。rhod是自然界中广泛分布的一类硫转移酶,会以单一结构域、串联结构域或与其他蛋白融合形式存在,在不含有sqr-pdo的微生物中也多有分布。现有研究发现其参与氰化物脱毒、铁硫簇合成及硒代谢等多种生理功能。对于在sqr和pdo组成的操作子结构中发现的rhod相关研究多集中在其生化活性的分析,但对其在h2s氧化途径中的生理意义尚未阐明。
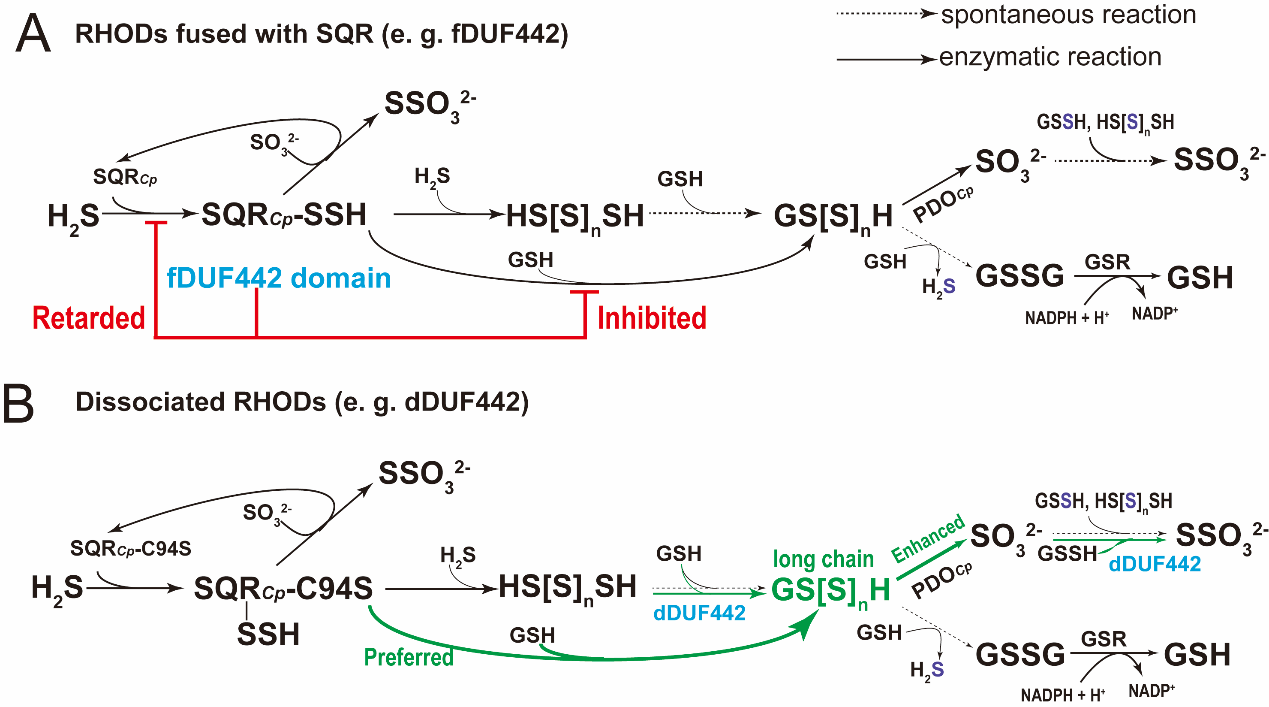
本研究发现,在目前已报道的存在于441个细菌基因组的454个sqr-pdo操纵子中,有84.8%的sqr-pdo操纵子附近存在不同形式的rhod蛋白或结构域,这表明rhod结构域确实在这条途径中分布广泛。以异养细菌cupriavidus pinatubonensisjmp134的sqr-pdo途径为研究对象,发现在sqrcp-pdocp氧化h2s过程中,与sqrcp融合表达的rhod结构域duf442失活(sqrcp-c94s)会使h2s氧化速率加快,硫烷积累,硫代硫酸盐产生增加。而游离表达的duf442回补则可降低胞内硫烷积累和硫代硫酸盐生成。另外发现sqrcp-c94s突变株在氧化h2s的过程中,其胞内gsh/gssg的比例短期内迅速下降,这会导致细胞受到二硫键的氧化压力。回补融合型或游离型的duf442都维持了还原型gsh的水平,避免了这种压力的生成。这表明rhod在细胞氧化h2s的过程中维持了胞内氧化还原稳态。
对sqrcp及sqrcp-c94s氧化h2s速率进行测定,发现sqrcp-c94s氧化h2s的速率明显加快,但回补游离型的duf442并不能缓解h2s氧化速率。这表明游离的duf442和融合型的duf442应该是通过不同机制来发挥作用的。另外,添加gsh明显加快sqrcp-c94s的氧化速率,但是对sqrcp没有影响。由此推测,融合型duf442结构域阻止了gsh作为sqrcp催化的直接受体,进而抑制了sqrcp的活性,缓解了硫烷的产生和积累。进一步借助alphafold2模拟了膜蛋白sqrcp的结构,结果表明其duf442结构域和催化结构域之间存在较长的柔性linker区域。因此,duf442结构域具备可移动性,可以在sqrcp氧化h2s时移到催化活性中心影响其活性。
游离型duf442无法影响sqrcp的酶活,却显著增强了pdocp的酶活。pdo活性的提高是细胞避免h2s氧化过程中硫烷积累的主要原因。借助生化活性分析,发现游离型duf442主要影响了pdocp的vmax,但对km值影响不大。借助质谱检测,我们发现duf442促进了更长链gsnh的产生。进一步对gs3h, gs4h及gs5h与pdocp的催化活性口袋进行分子对接,发现pdocp的活性口袋可以容纳长达5个硫原子的gs5h。而长链的硫烷可以一次性携带多个s0原子进入酶活中心。这相比短链的gssh,可以节省底物进入催化中心的时间,从而提高了酶的催化速率。
综上所述,本研究揭示了广泛分布于h2s氧化途径中的不同类型的硫转移酶借助两种作用机制维持了h2s氧化过程中细胞内氧化还原稳态的生理功能。这一研究揭示出硫转移酶的新功能,补足了对sqr-pdo途径中关键酶研究的缺失,丰富了对广泛存在于生物体内rhod的生理功能的认知。
本研究要特别感谢微生物代谢调控与生物合成团队的李庆宾博士在分子对接实验上给予的无私帮助;也特别感谢国家自然科学基金和山东大学齐鲁青年学者基金等科研项目的支持。


