近日,环境研究院姜威教授课题组在wiley出版社旗下的纳米材料领域旗舰期刊small(中科院一区top/jcr q1,if=15.153)上发表题为“2d mos2nanosheets induce ferroptosis by promotingncoa4-dependentferritinophagyand inhibitingferroportin”的研究论文(doi.10.1002/smll.202208063),被精选为当期frontispiece(扉页论文)高亮推荐。该研究首次报道了2dmos2纳米片通过促进ncoa4依赖的铁蛋白过度自噬和铁外排蛋白抑制从而导致细胞铁死亡的毒性分子机制,这对于阐明二维纳米颗粒的毒性和确定其医学应用具有重要意义。课题组博士生刘丙岩为论文第一作者,姜威教授为论文通讯作者。山东大学为第一作者单位和通讯作者单位。

图1期刊封面
二维过渡金属硫化物(2d tmdcs),由于其独特的物理化学性质,可以用作润滑剂、催化材料和药物递送载体等。mos2是一种典型的tmdc,由一层钼和两侧的硫层结合而成。作为后石墨烯时代的二维材料,mos2纳米片在药物传递、基因传递、光疗、联合治疗、生物成像、治疗学和生物传感等生物医学领域具有广泛的应用。
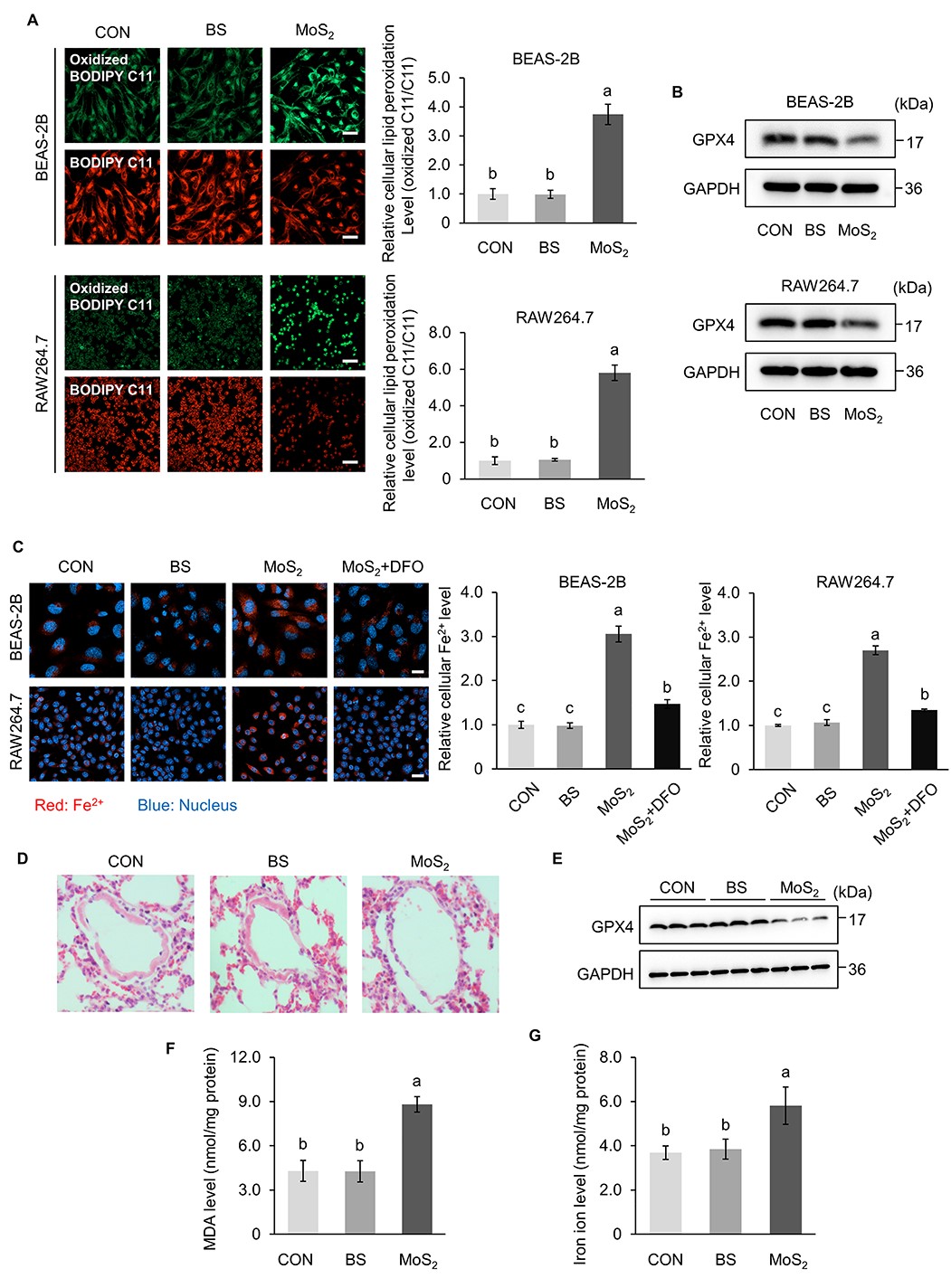
图2mos2纳米片在体内和体外引发铁死亡。mos2纳米片暴露后铁死亡关键指标脂质过氧化水平、fe2 水平、gpx4蛋白质水平显著改变;小鼠肺部组织切片中出现支气管壁损伤和免疫细胞浸润
铁死亡是一种近年来定义的依赖铁的程序性细胞死亡模式,是细胞内fe2 以芬顿反应方式氧化细胞膜上高表达的多不饱和脂肪酸从而引发脂质过氧化所致,同时伴随着膜脂修复酶谷胱甘肽过氧化物酶4(gpx4)的失效。铁死亡与许多人类疾病密切相关,二维mos2纳米片的广泛使用增加了人体暴露的几率并引发健康风险。然而,人们对mos2纳米片暴露后的毒性了解有限,mos2纳米片是否引起铁死亡及其分子机制尚不清楚。为了解决上述问题,课题组选择肺上皮细胞系beas-2b和参与免疫防御调节的单核巨噬细胞raw264.7作为体外模型。同时还建立了小鼠mos2纳米片吸入暴露模型。研究结果证实了mos2纳米片在体内和体外诱导铁死亡,并且铁死亡是由mos2纳米片本身而不是溶解离子引起的。细胞暴露于mos2纳米片后,大多数mos2纳米片通过巨胞饮作用进入细胞并定位于溶酶体,导致溶酶体膜通透性(lmp)增加。同时,核受体共激活因子4 (ncoa4)依赖的铁蛋白自噬被过度激活,铁蛋白在溶酶体中降解,释放出大量fe2 ,随后fe2 渗漏到细胞质中,最终导致铁死亡。此外,铁外排蛋白(fpn)是目前唯一已知的细胞铁输出蛋白,mos2纳米片暴露后对其表达水平的抑制进一步促进了细胞中fe2 的过载,从而加剧细胞铁死亡。在体内模型中还观察到,暴露于mos2纳米片的小鼠肺部组织中的铁死亡水平增加,并且在小鼠肺组织中检测到过度的铁蛋白自噬和铁外排蛋白抑制,这进一步印证了体外实验的结果。
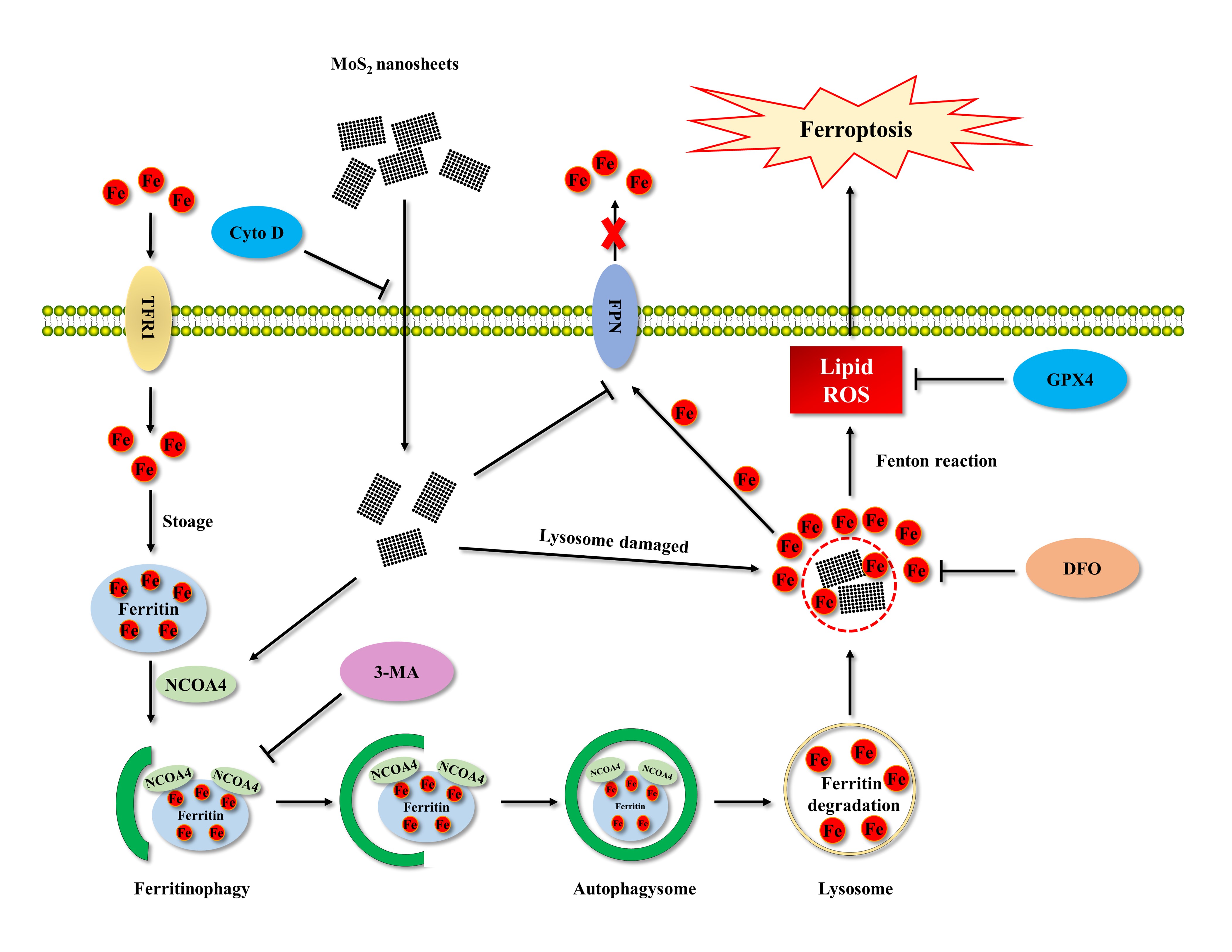
图3mos2纳米片引发铁死亡分子机制
本研究首次发现了mos2纳米片诱导beas-2b和raw264.7细胞铁死亡的分子机制,即由于ncoa4依赖的过度铁蛋白自噬和fpn的抑制。研究成果为2dmos2纳米片的毒性机制提供了新的认识,其通过诱导细胞fe2 过载的特性可与传统抑制脂质过氧化的小分子抗癌药物协同作用,开发为更加有效的诱导肿瘤细胞铁死亡的药物,为其在临床中肿瘤的发生、发展和耐药性相关领域提供潜在的医疗应用价值。
本研究工作得到了国家自然科学基金、山东省自然科学基金的支持。
原文链接:


